雷曹琦课题组在抗病毒天然免疫研究领域取得新进展
生命科学学院徐嫣然、施梦玲和华中科技大学张煜博士为本论文的共同第一作者,孔娜、王聪和肖一峰等同学为论文共同作者,雷曹琦为通讯作者。此外,武汉大学杜世燊教授和中国农业科学院兰州兽医研究所朱启运研究员也参与了该项研究。该工作依托于武汉大学生命科学学院和病毒学国家重点实验室,受到了国家自然科学基金、湖北省青年拔尖人才计划、中央高校基本科研业务费专项资金、家畜疫病病原生物学国家重点实验室资助。
天然免疫是宿主抵御病毒感染的第一道防线。2005年,舒红兵院士团队鉴定发现了关键接头蛋白VISA(又称MAVS)在抗RNA病毒免疫应答中具有不可或缺的作用。VISA的功能受各种翻译后修饰的严格调控,如多聚泛素化、磷酸化和糖基化修饰,但其他翻译后修饰是否调节VISA介导的抗病毒天然免疫反应尚待发现。
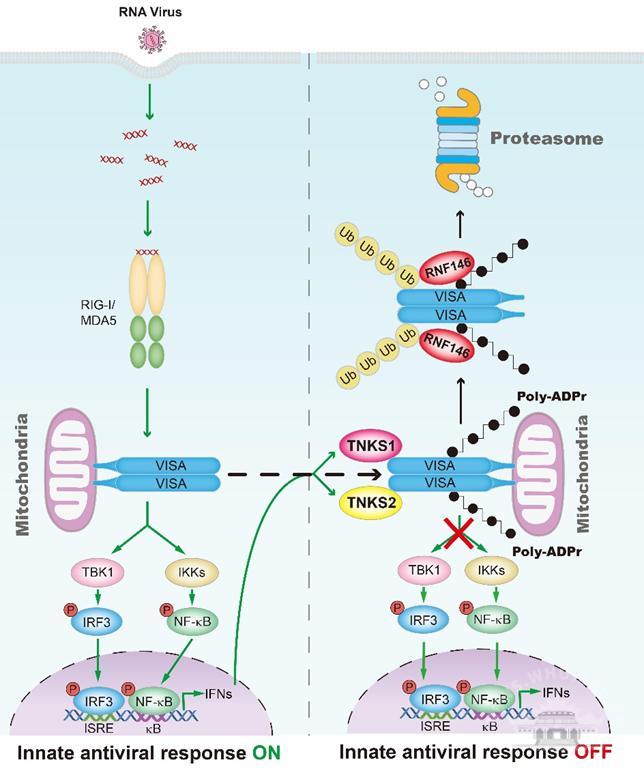
二磷酸腺苷核糖多聚化(PARylation)是一种由聚腺苷二磷酸核糖聚合酶(PARP)家族蛋白催化的可逆的蛋白翻译后修饰过程。雷曹琦课题组首次发现VISA能够被Tankyrase1(TNKS1,PARP5a)及其同源蛋白TNKS2(PARP5b)进行PARylation修饰并降解,进而抑制抗病毒天然免疫反应。
该研究小组发现病毒感染能诱导TNKS1和TNKS2的表达,并促进其转移到线粒体与VISA相互作用。TNKS1/2进而介导VISA在137位谷氨酸发生PARylation修饰,此修饰为E3泛素连接酶RNF146提供了识别信号,从而招募并活化RNF146。RNF146进一步介导VISA发生K48连接的多聚泛素化,并通过蛋白酶体降解VISA,抑制RNA病毒诱导的天然免疫反应。该研究首次发现了VISA的PARylation修饰,并揭示了PARylation修饰和泛素化修饰动态调控VISA蛋白稳定性的新机制。来源:武汉大学



